Recommendations pour prévenir les transfusés en cas de rappeld'un rappel de produits
Tanya Petraszko, M.D. (Co-présidente)
Ann Tran, M.D.
Lakshmi Rajappannair, M.D.
Robert Liwski, M.D.
Marissa Laureano, M.D.
Mark Bigham, M.D.
Mindy Goldman, M.D.
Steven Drews, Ph. D.
List of abbreviations
Cytomégalovirus
Maladie de Creutzfeldt-Jakob
Paludisme transmis par transfusion
Variante de la maladie de Creutzfeldt-Jakob
Comité consultatif national des transfusés
Comité consultatif national sur le sang et les produits sanguins
Provinces et territoires
Sans objet
Test d’amplification des acides nucléiques
Virus Epstein-Barr
Summary of Revisions
Revision Date
Details

Coche : signe de validation pour la colonne considérée. Voir la colonne opposée pour toute exception.
Composant sanguin connexe : composant sanguin provenant du même don que le composant principalement visé par le rappel (culot globulaire) ou produit à partir de la même unité de sang (unité de plaquettes mélangées provenant du même don que l’unité de globules rouges concernée).
Notification non recommandée : dans un tel cas, aucune investigation/action supplémentaire n’est nécessaire.
Notification recommandée : dans un tel cas, une investigation est recommandée et peut inclure une consultation du dossier du patient, un entretien avec son médecin pour de plus amples renseignements ou des recommandations d’examens et/ou la notification du patient..
Rappel : retrait du circuit de distribution ou des hôpitaux d’un produit (composant sanguin) non conforme à la législation administrée par Santé Canada (exigence réglementaire).
Rappel à grande échelle : rappel d’au moins 50 composants sanguins OU rappel d’un petit nombre de composants sanguins touchant plusieurs provinces. Ne comprend pas les rappels courants émis pour les raisons décrites dans le présent document.
Rappel exceptionnel : rappel d’un petit ou d’un grand nombre de composants sanguins pour une cause imprévue.
Retrait : acte du fabricant (fournisseur de sang) de retirer volontairement un produit (composant sanguin) pourtant conforme à la législation administrée par Santé Canada.
S.O. : sans objet pour la colonne considérée. Voir les notes dans la colonne opposée.
Le Comité consultatif national sur le sang et les produits sanguins (CCN) est une instance médicale et technique interprovinciale rattachée aux ministères provinciaux et territoriaux de la Santé ainsi qu’à la Société canadienne du sang. Il a pour mandat de fournir des conseils professionnels sur des sujets influençant directement la pratique transfusionnelle en milieu hospitalier et de se positionner en tant qu’autorité en la matière. En 2010, le Comité de liaison Société canadienne du sang – provinces/territoires sur le sang (CLSCS-P/T) lui a confié plusieurs tâches :
- formuler des recommandations nationales afin d’assurer l’uniformité du processus de notification des transfusés en cas de rappels ou de retraits de composants sanguins;
- déterminer le responsable de chaque étape du processus de notification;
- recommander des spécialistes ayant les compétences nécessaires pour organiser la notification en cas de retraits ou de rappels exceptionnels ou à grande échelle dans les situations qui ne sont pas expressément traitées dans les recommandations nationales.
Les recommandations énumérées dans le présent document sont le fruit d’une collaboration entre le CCN et la Société canadienne du sang. Il est conseillé aux services transfusionnels des hôpitaux, à la Société canadienne du sang et aux représentants des gouvernements provinciaux et territoriaux de les utiliser comme guide de référence.
Si un retrait et un rappel se définissent différemment (voir la liste de définitions), leurs conséquences sur le composant sanguin visé sont les mêmes : la Société canadienne du sang le retire des stocks et informe les services transfusionnels des hôpitaux ayant reçu le composant en question ou des composants connexes. Dans le cadre du présent document, « retrait » et « rappel » seront considérés comme équivalents, et le terme « rappel » sera utilisé pour signifier les deux processus.
Les recommandations ici formulées sont la ligne de conduite suggérée pour avertir les transfusés. Les recommandations générales portent sur les rappels habituels émis par la Société canadienne du sang, qui dessert tout le pays à l’exception du Québec. Ce document n’est pas limitatif : les provinces, territoires et hôpitaux peuvent, s’ils le souhaitent, aller au-delà de ces recommandations ou adapter le processus à leurs particularités locales.
Il est recommandé à tous les hôpitaux d’adopter leur propre politique et procédure de notification conformément à la réglementation provinciale ou territoriale. Chaque hôpital devrait avoir une procédure interne, la personne chargée d’avertir les transfusés devant être clairement identifiée et la méthode de notification, bien définie. Il est en outre recommandé de consulter les responsables locaux de la gestion des risques lors de l’élaboration de la procédure.
Ce document ne vise pas les rappels émis lorsqu’un donneur se révèle positif pour l’hépatite B, l’hépatite C, le VIH, le HTLV, la syphilis, le virus du Nil occidental ou le Tripanosoma cruzi (maladie de Chagas). Dans de tels cas, la Société canadienne du sang indiquera aux hôpitaux les mesures à prendre dans le cadre de la procédure d’enquête visant à retracer les personnes ayant reçu des composants des donneurs infectés.
Pour l’instant, le présent document ne concerne que la notification, aux transfusés, des rappels de composants sanguins frais recueillis, produits ou distribués par la Société canadienne du sang (culots globulaires, plaquettes et composants plasmatiques congelés). Toutefois, cela pourrait s’appliquer aux rappels exceptionnels ou à grande échelle de protéines plasmatiques fractionnées ou recombinantes. Dans pareil cas, le Comité consultatif national des transfusés (CCNT) pourrait être amené à se réunir (voir Section 7).
Les présentes recommandations ont été élaborées en tenant compte de la littérature existante. Certaines situations cliniques requièrent une attention particulière du médecin dans le cadre d’une évaluation plus précise des recommandations de notification présentées ici. Il s’agit des données cliniques suivantes, sans toutefois s’y limiter :
- présence ou absence de symptômes durant ou après la transfusion (risque de contamination bactérienne ou de paludisme);
- grossesse (prise de médicaments tératogènes);
- pathologie sous-jacente (patient immunodéprimé et donneur atteint du VEB);
- âge du patient;
- pronostic.
Selon l’âge du transfusé et le pronostic, le médecin traitant pourrait choisir d’avertir le parent le plus proche ou les membres de sa famille au lieu d’informer le transfusé directement. La notification doit se faire dans le respect de la réglementation provinciale en vigueur.
Dans les cas où il n’est pas recommandé d’informer le transfusé et où il est nécessaire de consulter son dossier médical pour le confirmer, l’hôpital doit consigner chaque fois où le dossier a été consulté pour vérifier de l’information. S’il est recommandé d’informer le patient, il faut prévenir le transfusé du rappel et, le cas échéant, effectuer les analyses complémentaires dans les plus brefs délais en fonction des risques relatifs associés à la cause du rappel.
S’il est nécessaire d’obtenir des précisions ou de plus amples renseignements sur un avis de rappel, il est recommandé de s’adresser à un médecin de la Société canadienne du sang.
Les rappels de composants sanguins sont émis par la Société canadienne du sang conformément à la réglementation de Santé Canada et aux procédures opérationnelles normalisées.
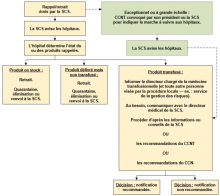
Dès que la décision de retirer des composants sanguins de la circulation est prise, la Société canadienne du sang informe les hôpitaux par la voie habituelle. Il s’agit ensuite de décider si le receveur, le cas échéant, doit être informé du rappel.
Si le rappel est dû à la découverte d’un marqueur de maladie infectieuse, la Société canadienne du sang guidera les hôpitaux concernés dans le processus de notification des transfusés, ainsi que dans la procédure d’enquête à mener. Comme l’illustre la figure 1 ci-dessous, le CCNT peut émettre une recommandation concernant la notification des transfusés si ce rappel est exceptionnel ou s’il vise une grande quantité de composants sanguins. La Société canadienne du sang en informe alors les hôpitaux par les voies de communication habituelles. Les hôpitaux ne sont pas tenus de se reporter aux recommandations du CCN, sauf s’ils ont besoin d’information sur le fonctionnement et le champ de compétences du CCNT.
Figure 1 : Processus menant à la décision d’informer ou non les transfusés d’un rappel de produits
Les sections suivantes (de 3.0 à 6.0) fournissent des recommandations relatives à la notification en fonction du motif de rappel. Les définitions suivantes s’appliquent à l’ensemble des quatre sections :
Notification recommandée : dans un tel cas, une investigation est recommandée et peut inclure une consultation du dossier du patient, un entretien avec son médecin pour de plus amples renseignements ou des recommandations d’examens et/ou la notification du patient.
NoNotification non recommandée : dans un tel cas, aucune investigation/action supplémentaire n’est nécessaire.
S.O. : sans objet pour la colonne considérée. Voir les notes dans la colonne opposée.
Coche : signe de validation pour la colonne considérée. Voir la colonne opposée pour toute exception.
Tableau 1 : Rappels émis à la suite d’informations que le fournisseur de sang a reçues après le don.
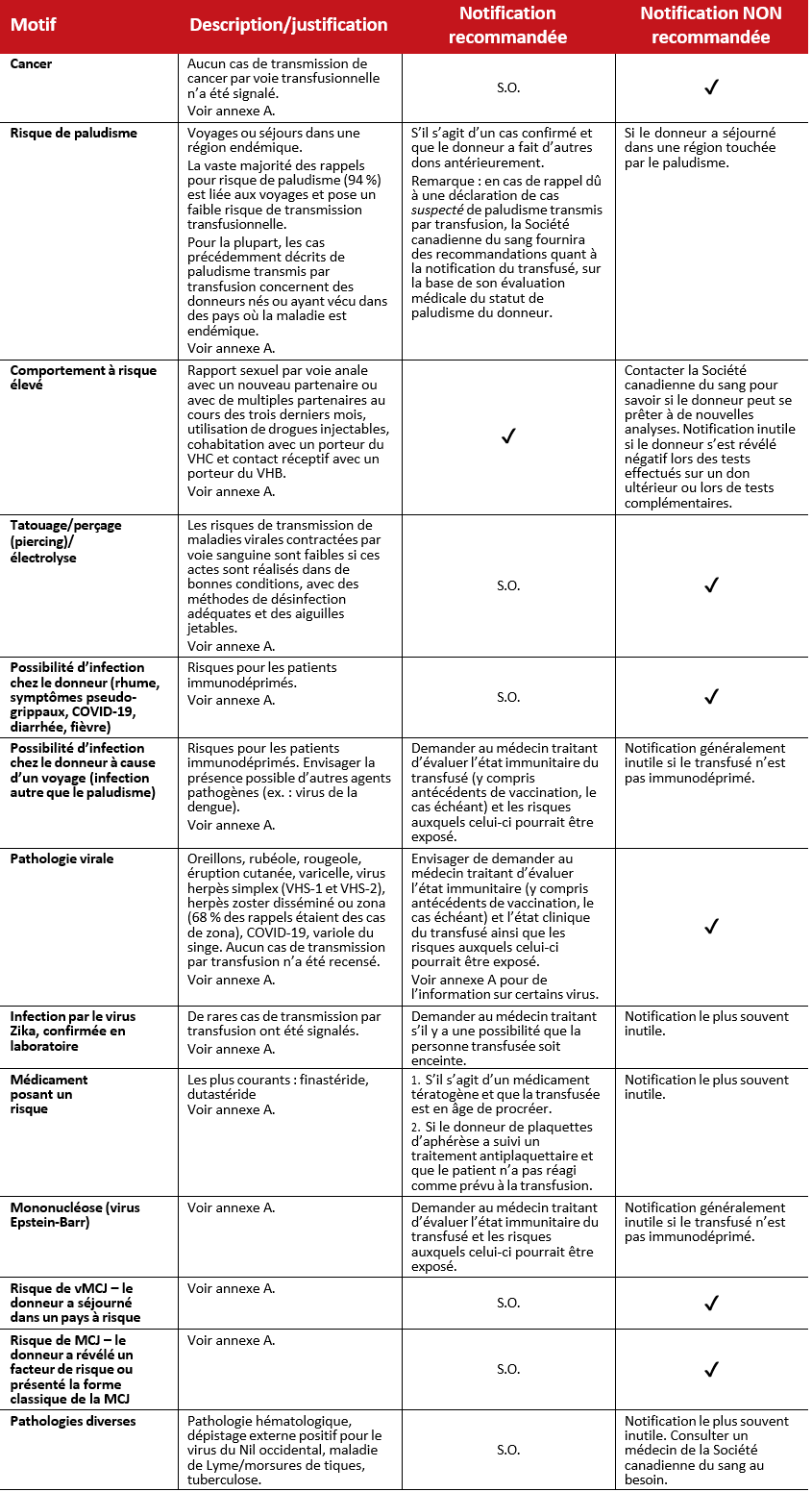
Remarque : Plus de 90 % des rappels annuels relevant de cette catégorie étaient liés à l’une des raisons ci-dessus (d’après les données de 2021-2022 de la Société canadienne du sang).
Tableau 2 : Rappels émis par la Société canadienne du sang à la suite de problèmes de fabrication.
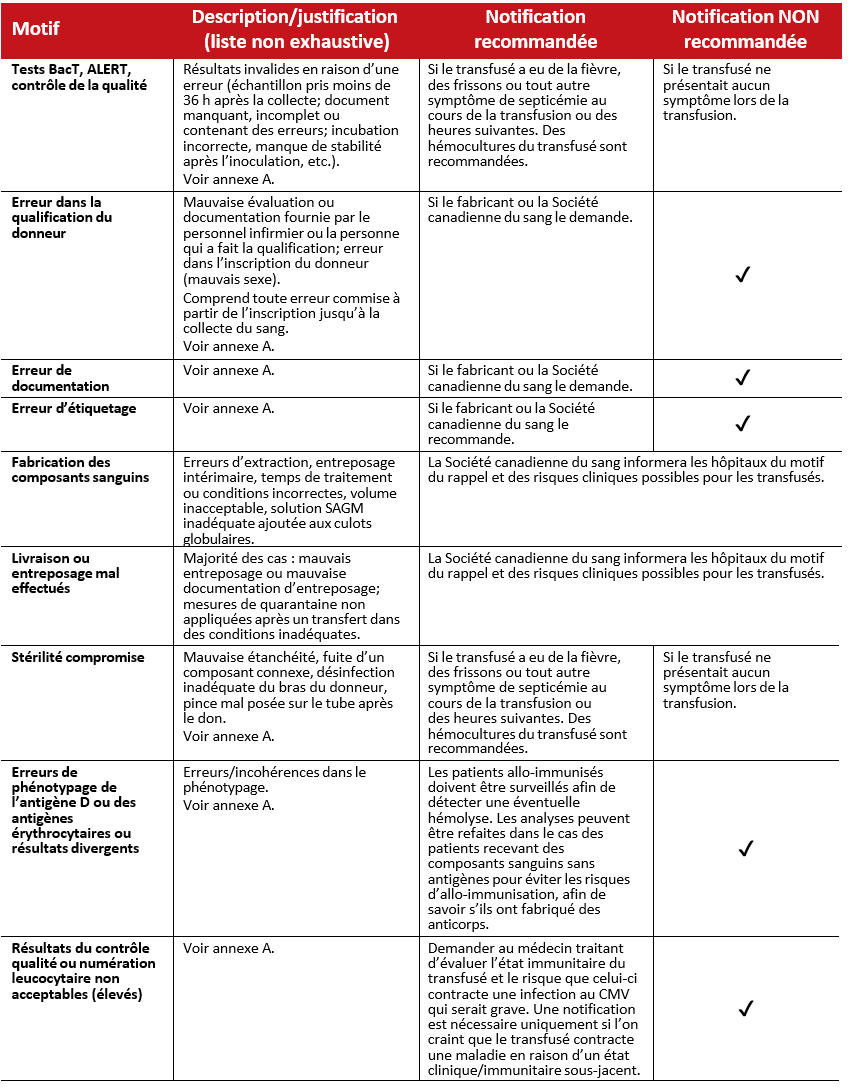
Remarque : Plus de 90 % des rappels annuels relevant de cette catégorie étaient liés à l’une des raisons ci-dessus (d’après les données de 2021-2022 de la Société canadienne du sang).
Tableau 3 : Rappels émis en cas de risque de contamination bactérienne d’un composant sanguin.
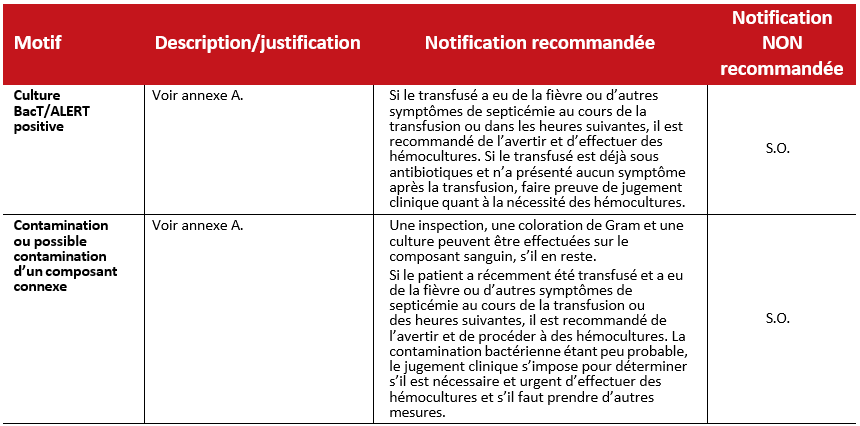
Tableau 4 : Rappels émis en raison d’un cas de TRALI

En cas de rappel pour des circonstances extraordinaires ou de rappel visant un grand nombre de composants sanguins, il est recommandé que le Comité consultatif national des transfusés (CCNT) se réunisse afin de formuler des recommandations concernant la notification des transfusés. Les spécialistes de ce comité peuvent aussi faire des recommandations pour des rappels de produits non évoqués dans le présent document.
Pour décider si les patients seront informés du rappel de produits, la Société canadienne du sang se basera d’abord sur les recommandations du CCNT.
Le mandat de ce comité est le suivant :
7.1 Mandat
Le CCNT fera des recommandations à la Société canadienne du sang et la conseillera sur la marche à suivre pour informer les transfusés dans le cas du rappel d’un grand nombre de composants sanguins ou lors d’une situation non prévue par les recommandations nationales.
Les membres du CCNT devront :
- décider si les receveurs des produits rappelés doivent être informés du rappel;
- formuler des recommandations afin que tous les transfusés au pays soient avertis selon la même procédure pour le même type de rappel;
- déterminer si des analyses complémentaires sont nécessaires pour les patients ayant reçu les composants sanguins visés par le rappel;
- formuler des recommandations sur les renseignements à fournir aux hôpitaux par l’entremise de la Société canadienne du sang.
7.2 Composition
Le président du CCN présidera le CCNT et sera suppléé par le vice-président du CCN.
Membres du CCNT :
- le directeur général de la chaîne d’approvisionnement de la Société canadienne du sang;
- le président et le vice-président du CCN (ou leurs remplaçants désignés);
- le vice-président aux affaires médicales et à l’innovation de la Société canadienne du sang;
- un représentant de la province responsable (personne chargée du dossier du sang);
- tout autre spécialiste de manière ponctuelle en fonction de la taille et de la nature du rappel, y compris, mais sans toutefois s’y limiter :
- membres du Comité national d’urgence pour la gestion des réserves de sang (CNUGRS);
- un éthicien;
- un représentant des transfusés; soit une personne transfusée elle-même, soit un représentant d’une association de patients;
- un représentant de l’Agence de la santé publique du Canada.
7.3 Réunions
Les réunions seront convoquées par la Société canadienne du sang ou le président du Comité. Les décisions du CCNT devront être prises par consensus, c’est-à-dire par approbation d’au moins 80 % des membres votants présents.
Si un consensus n’est pas atteint, la Société canadienne du sang prendra les décisions en se basant sur les conseils reçus du CCNT.
Le secrétariat du CNUGRS se chargera de l’organisation des téléconférences et des réunions, rédigera les procès-verbaux et les comptes rendus de décisions, puis les transmettra aux parties intéressées. Il verra également à tenir à jour le nom et les coordonnées des membres du CCNT.
Le Comité consultatif national sur le sang et les produits sanguins et la Société canadienne du sang souhaitent remercier les Dres Mindy Goldman et Margaret Fearon, de la Société canadienne du sang, ainsi que Nancy Heddle, de l’Université McMaster, pour leurs précieuses contributions à la version initiale du présent document.
References
GÉNÉRALITÉS
INSTITUT CANADIEN POUR LA SÉCURITÉ DES PATIENTS. Lignes directrices nationales relatives à la divulgation. Mai 2011. Disponible en ligne, à l’adresse : https://www.patientsafetyinstitute.ca/fr
HEDDLE, N.M. et coll. Transfusion Service: A policy informing qualitative study to improve the process of blood product recalls and withdrawals. Transfusion. 2008, vol. 48, no 12, p. 2585-2595.
Recommandations pour la notification des receveurs à la suite d’un retrait de produits sanguins. Gouvernement du Québec. Québec. SeSS. 2004
EDER, A. et M. GOLDMAN. Post-donation Information and Blood Component Retrievals: Realigning Blood Center and Hospital Actions Based on Risk Assessment. Transfusion Medicine Reviews. 2014; 28:226-234.
RAMSEY, G. Blood component recalls and market withdrawals: frequency, reasons, and management in the United Status. Transfusion Medicine Reviews. 2013; 27:82-90.
LINDHOLM, P.F., ANNEN K., et RAMSEY G. Approaches to minimize infection risk in blood banking and transfusion practice. Infect Disord Drug Targets 2011; 11(1):45-56.
BacT/ALERT, INVALIDITÉ DES TESTS
RAMIREZ-ARCOS. S., EVANS, S., MCINTYRE, T., PANG, C., YI, Q.-L., DIFRANCO, C., GOLDMAN, M. Extension of platelet shelf life with an improved bacterial testing algorithm. Transfusion. 2020, vol. 60, p. 2918-2928.
CONTAMINATION BACTÉRIENNE
Culture BacT/ALERT positive, contamination ou possible contamination d’un composant connexe : Bacterial Contamination of Platelets: Summary for Clinicians on Potential Management Issues Related to Transfusion Recipients and Blood Donors. AABB Bacterial Contamination Task Force. 23 février 2005. Disponible en ligne, à l’adresse https://www.aabb.org/regulatory-and-advocacy/regulatory-affairs/regulatory-for-blood/platelet-components.
Lignes directrices relatives aux enquêtes sur les cas soupçonnés de contamination bactérienne transfusionnelle. Relevé des maladies transmissibles au Canada. 2008, vol. 34S1. Disponible en ligne à l’adresse : https://www.canada.ca/fr/sante-publique/services/rapports-publications/releve-maladies-transmissibles-canada-rmtc/numero-mensuel/2008-34/lignes-directrices-relatives-enquetes-contamination-bacterienne-transfusionnelle.html.
EDER, A. et M. GOLDMAN. How do I investigate septic transfusion reactions and blood donors with culture-positive platelet donations? Transfusion. 2011, vol. 51, p. 1662.
CANCER
EDGREN, G., H. HJALGRIM, M. REILLY et coll. Risk of cancer after blood transfusion from donors with subclinical cancer: a retrospective cohort study. The Lancet. 2007, vol. 369, p. 1724-1730.
YANG, H., LEE, J., SEED, C.R. et KELLER, A.J. Can Blood Transfusion Transmit Cancer? A Literature Review. Transfusion Medicine Reviews. 2010, vol. 24, p. 235-243.
HJALGRIM, H., ROSTGAARD, K., VASAN, S.K., et coll. No evidence of transmission of chronic lymphocyte leukemia through blood transmission. Blood. 2015, vol. 126, p. 2059-2061.
MCJ
URWIN, P.J., MACKENZIE, J.M., LLEWELYN, C.A., WILL, R.G., HEWITT, P.E. Creutzfeldt‐Jakob disease and blood transfusion: updated results of the UK Transfusion Medicine Epidemiology Review study. Vox Sang. 2016, vol. 110; p. 310-316.
CROWDER, L.A., SCHONBERGER, L.B., DODD, R.Y., STEELE, W.R. Creutzfeldt-Jakob disease lookback study: 21 years of surveillance for transfusion transmission risk. Transfusion. 2017, vol. 57, p. 1875-1878.
ZONES À RISQUE POUR LA vMCJ (voyages et transfusion)
FDA Guidance for Industry: Recommendations to Reduce the Possible Risk of Transmission of Creutzfeldt‐Jakob Disease and Variant Creutzfeldt‐Jakob Disease by Blood and Blood Components, mai 2022. Disponible en ligne à l’adresse :
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/recommendations-reduce-possible-risk-transmission-creutzfeldt-jakob-disease-and-variant-creutzfeldt
SEED C.R., HEWITT P.E., Dodd R.Y., HOUSTON F., CERVENAKOVA L. Creutzfeldt-Jakob disease and blood transfusion safety. Vox Sang. 2018, vol. 113; p. 220-231.
MCMANUS, H., SEED, C.R., HOAD, V., et coll. Risk of variant Creutzfeldt-Jakob disease transmission by blood transfusion in Australia. Vox Sang. 2022, vol. 117, p. 1016-1026.
University of Edinburgh CJD International Surveillance Network. À l’adresse : https://www.eurocjd.ed.ac.uk/data_tables. Consulté le 13 janvier 2023.
COVID-19 (virus SARS-CoV-2)
LEBLANC, J.F. et coll. Risk of transmission of severe acute respiratory syndrome coronavirus 2 by transfusion: A Literature Review. Transfusion. 2020, vol. 60, p. 3046-3054.
KIELY, P. et coll. Severe Acute Respiratory Syndrome Coronavirus 2 and blood safety: an updated review. Transfus Med Hemother. 2022, vol. 49, p. 218-228.
CAPPY, P. et coll. SARS-CoV-2 and post-donation information: a one-year experience of the French haemovigilance network. Blood Transfusion. 2022, vol. 20, p. 362-373.
LUZZI, J.R. et coll. COVID-19: Further evidence of no transfusion transmission. Transfusion and Apheresis Science. 2021, vol. 60, p. 102961.
COMPORTEMENT À HAUT RISQUE
O’BRIEN, S.F., YI, Q.L., FAN, W. et coll. Residual risk of HIV, HCV and HBV Canadian. Transfusion and Apheresis Science. 2017, vol. 56, p. 389-391.
Rapport de surveillance de la Société canadienne du sang, 2021. Disponible en ligne à l’adresse : https://professionaleducation.blood.ca/fr/transfusion/publications/rapport-de-surveillance.
INFECTION
Donneur ayant peut-être une infection (rhume, grippe, fièvre, diarrhée)
GOLDMAN, M., LONG, A., ROY, G. et coll. Incidence of Positive Bacterial Cultures after Donor Call-Back. Transfusion. 1996, vol. 36, p. 1035.
EDER, A.F et M. GOLDMAN. How do I investigate septic transfusion reactions and blood donors with culture-positive platelet donations? Transfusion. 2011, vol. 51, p. 1662‐1668.
Infection virale possible
Site Internet de l’AABB : https://www.aabb.org/regulatory-and-advocacy/regulatory-affairs/infectious-diseases/emerging-infectious-disease-agents/fact-sheets-created-or-updated-post-publication-of-the-transfusion-august-2009-supplement. Emerging infectious disease agents and their potential threat to transfusion safety. Transfusion. 2009, supplément 49.
Y compris fiches signalétiques :
- Virus herpétiques de type 1 et 2, varicelle et zona
- Virus de l’influenza A ou B
- Oreillons
- Mononucléose (virus Epstein-Barr)
- Virus Zika
- Autres agents pathogènes
PALUDISME
MUNGAI, M, TEGTMEIER, G, CHAMBERLAND, M et PARISE, M. Transfusion-transmitted malaria in the United States from 1963 through 1999. N Engl J Med. 2001, vol. 344, p. 1973‐1978.
MACE, K.E., LUCCHI, N.W., TAN, K.R. Malaria Surveillance – United States, 2017. MMWR 2021. Disponible en ligne à l’adresse : https://www.cdc.gov/mmwr/volumes/70/ss/ss7002a1.htm.
SPENCER, B., STEELE, W., CUSTER, B., KLEINMAN, S. et coll. Risk for malaria in United States donors deferred for travel to malaria-endemic areas. Transfusion. 2009, vol. 49, p. 2335‐2345.
SPENCER, B., KLEINMAN, S., CUSTER, B. et coll. Deconstructing the risk for malaria in United States donors deferred for travel to Mexico. Transfusion. 2011, vol. 51, no 11, p. 2398-2410.
ROUGEOLE, OREILLONS ET RUBÉOLE
FORTHAL, D.N., AARNAES, S., BLANDING, J., DE LA MAZA, L., TILES, J.G. Degree and length of viremia in adults with measles. Journal of Infectious Diseases. 1992, vol. 166; p. 421-4.
SHIN, S., LEE, S., CHO, Y., SHIN, Y. Blood‐borne transmission of the measles, mumps, and rubella vaccine virus. Transfusion. 2011, vol. 51, p. 663‐664.
MÉDICAMENTS POSANT UN RISQUE
HAN, J.Y., CHOI, J.S., CHUN, J.M., PARK, H.D. et coll. Pregnancy outcome of women transfusion during pregnancy with blood products inadvertently obtained from donors treated with acitretin. J Obs Gyn. 2009, vol. 29, p. 694-697.
GEIGER, J.M., BOUDIN, M., SAURAT, J.H. Teratogenic Risk with etretinate and acitretin treatment. Dermatology. 1994, vol. 189; p. 109-116.
MPOX (VARIOLE DU SINGE)
Monkey pox Virus – Interim Fact Sheet. Disponible en ligne à l’adresse :
https://www.aabb.org/docs/default-source/default-document-library/regulatory/interim-monkeypox-virus-fact-sheet.pdf.
DODD, R.Y., STRAMER, S.L. Monkeypox and transfusion safety. Transfusion Medicine Reviews. 2022, vol. 14, p. 49
TATOUAGE, PERÇAGE (PIERCING) ET ÉLECTROLYSE
GOLDMAN, M., XI, G., YI, Q.L., FAN, W. et coll. Reassessment of deferrals for tattooing and piercing. Transfusion. 2009, vol. 49, p. 648‐654.
HOAD, V., GUY, R.J., SEED, C.R., HARLEY, R. Tattoos, blood-borne viruses and blood donors: a blood donor cohort and risk assessment. Vox Sang. 2019, vol. 114, p. 687-693.
PRINSZE, F.J., VAN DE LAAR, T., SLOT, E., et coll. No increased risk of transfusion-transmissible infections after tattooing, body piercing, or acupuncture among blood donors in the Netherlands. Transfusion. 2019, vol. 59, p. 2575-2583.
TRALI
SEMPLE, J.W., REBETZ, J., KAPUR, R. Transfusion-associated circulatory overload and transfusion-related acute lung injury. Blood. 2019, vol. 133, p. 1840-1853.
VARICELLE, ZONA ET HERPÈS DE TYPE 1 ET 2
HUDNALL, S.D., CHEN, T., ALLISON, P., TYRING, S.K. et HEATH, A. Herpes virus prevalence and viral load in healthy blood donors by quantitative real time polymerase chain reaction. Transfusion. 2008, vol. 48, p. 1180‐1187.
KIMURA, H., KIDO, S., OZAKI, T. et coll. Comparison of quantitations of viral load in Varicella and Zoster. Journal of Clinical Microbiology. 2000, vol. 38, no 6, p. 247.
CHAN, H.M., HO, P.L., CHAN, K.H., LIN, C.K., LEE C.K. Interdiction of a blood donation containing varicella-zoster virus by donor self-report of chickenpox. Vox Sang. 2013, vol. 104, p. 248-249.
VIRUS ZIKA
BARJAS-CASTRO, M.L., ANGERAMI, R.N., CUNHA, M.S. et coll. Probable transfusion-transmitted Zika virus in Brazil. Transfusion. 2016, vol. 56; p. 1684-1688.
SAÁ, P., PROCTOR, B.S., FOSTER B.A. et coll. Investigational testing for Zika virus among U.S. blood donors. NEJM. 2018, vol. 378; p. 1778-88.
Appendices
INFORMATIONS POST-DON
Cancer
La plupart des types de cancer constituent un motif d’exclusion temporaire du don de sang jusqu’à ce qu’un intervalle précis sans récidive se soit écoulé. Beaucoup des renseignements reçus post-don concernent un diagnostic récent de cancer. Dans pareils cas, les composants sanguins sont rappelés s’ils n’ont pas encore été transfusés lorsque le donneur fournit cette information. Le plasma et le cryoprécipité peuvent être rappelés jusqu’à 12 mois après le don.
Une vaste étude de cohortes menée en Scandinavie pour mesurer l’incidence du cancer chez les personnes ayant reçu du sang de donneurs atteints d’un cancer subclinique lors de leur don a révélé qu’il n’y avait pas plus de risques de cancer chez ces transfusés que chez ceux qui avaient reçu du sang de donneurs n’ayant pas eu de cancer. N’ayant trouvé aucun élément prouvant que la formation d’un cancer chez les donneurs compromet l’innocuité, la pureté ou les propriétés des composants sanguins, la FDA n’exige pas le rappel des produits lorsqu’un cancer est diagnostiqué chez les donneurs. Il n’y a pas de preuve de transmission par transfusion en cas de cancer d’organe solide.
Risque de paludisme
Les rappels sont généralement liés au fait que les donneurs ont omis de mentionner qu’ils avaient séjourné dans un pays où sévit le paludisme. Les composants cellulaires doivent être retirés de la circulation lorsque six mois ou moins se sont écoulés entre le retour du donneur et son don. Le risque global de transmission du paludisme par voie transfusionnelle (paludisme TT) aux États-Unis et au Canada est de moins d’un par million de composants cellulaires transfusés. Aucun cas de paludisme transmis par transfusion n’a été signalé au Canada entre 1997 et 2021. Les États-Unis n’enregistrent, eux, qu’un ou deux cas par an. Un cas probable de paludisme TT a été décrit au Canada en 2022. Les individus concernés sont généralement des immigrants originaires de pays où sévit le paludisme. Les séjours de courte durée dans les régions où le paludisme est endémique posent un très faible risque de transmission de la maladie par transfusion. De plus, une exclusion de 21 jours post-voyage après un séjour en dehors du Canada, des États-Unis continentaux ou de l’Europe réduit le risque d’infections liées aux déplacements telles que le paludisme ou d’autres infections à arbovirus comme la dengue, le chikungunya ou Zika. Le paludisme contracté par voie transfusionnelle se manifeste par de la fièvre, de la fatigue, une anémie et un état de confusion mentale. Les symptômes associés au Plasmodium falciparum apparaissent habituellement deux ou trois semaines après la transfusion. D’autres espèces ont une durée d’incubation plus longue. Le Plasmodium malariae incube pendant 73 jours, par exemple.
Comportement à haut risque
Il arrive qu’un donneur signale avoir eu un comportement l’excluant à vie du don de sang, comme s’être injecté de la drogue. Si les faits sont récents, ses composants sanguins font l’objet d’un rappel. Si les résultats des tests de dépistage effectués lors du don étaient négatifs, les risques de transmission d’une maladie infectieuse sont probablement infimes. À l’heure actuelle, la période de latence sérologique du VIH, du VHC et du VHB utilisée pour les tests de détection de la Société canadienne du sang est respectivement de 6,1, 2,9 et 18,8 jours. Un patient infecté par l’un de ces virus peut être asymptomatique lors de la transfusion, mais les conséquences sur sa santé, celle des membres de son foyer et de ses partenaires sexuels peuvent être très graves.
Possibilité d’infection chez le donneur (rhume, symptômes pseudo-grippaux, COVID-19, diarrhée, fièvre)
L’apparition de symptômes tels que de la fièvre, des frissons et de la diarrhée chez un donneur dans les jours suivant son don peut révéler une bactériémie lors du don. Les hémocultures réalisées sur tous les concentrés plaquettaires ont permis d’en savoir plus sur l’origine de la bactériémie asymptomatique chez les donneurs. Il est particulièrement rare qu’une infection bactérienne du tube digestif ou des voies respiratoires supérieures encore en incubation donne lieu à une culture bactérienne positive. En règle générale, les virus respiratoires courants, souvent saisonniers, acquis dans la communauté, ne sont pas considérés comme transmissibles par voie transfusionnelle.
Possibilité d’infection chez le donneur à cause d’un voyage (infection autre que le paludisme)
Les donneurs qui, après avoir fait un voyage, présentent des symptômes comme de la fièvre, une conjonctivite et des douleurs articulaires, accompagnées ou non d’une éruption cutanée, ont un diagnostic différentiel plus large que les donneurs n’ayant pas voyagé à l’étranger. Une discussion avec les médecins de la Société canadienne du sang est recommandée, car le complément d’information ou d’analyses obtenu pourrait circonscrire l’étiologie, comme la corrélation avec les signes cliniques ou les symptômes observés chez le patient. Pour les donneurs qui ont voyagé dans des régions à risque pour le paludisme, consulter la section sur le risque de paludisme.
Tatouage, perçage (piercing) et électrolyse
Une exclusion temporaire de trois mois à titre de précaution est appliquée après un tatouage, un perçage ou une électrolyse avec des aiguilles non jetables. Les donneurs qui reviennent au terme d’une exclusion temporaire ne risquent pas plus que les autres donneurs d’être positifs pour le VHB ou le VHC. Ainsi, lorsque les périodes d’attente sont respectées, aucun de ces actes ne pose vraiment de risque supplémentaire d’infection.
Médicament posant un risque
Un rappel est émis lorsqu’un donneur signale avoir pris des médicaments fortement tératogènes qui, pris pendant la grossesse, peuvent provoquer des malformations congénitales. On ne dispose toutefois que de peu d’informations sur les risques encourus lors d’une seule exposition, à l’occasion d’une transfusion. La seule étude publiée sur le sujet n’a révélé aucun effet indésirable tel que des malformations congénitales chez les nouveau-nés de mères ayant pris l’un de ces médicaments, l’acitrétine, avant ou pendant leur grossesse. Les propriétés thérapeutiques des plaquettes peuvent par ailleurs être amoindries si le donneur a pris des médicaments ayant des effets antiplaquettaires, comme de l’AAS, lors de son don. Dans le cas de certains médicaments, l’altération des propriétés plaquettaires est réversible après la transfusion.
Séjour ou transfusion dans une région à risque pour la vMCJ
On a recensé quatre cas probables de transmission de la vMCJ par transfusion sanguine. Ces quatre cas sont survenus au Royaume-Uni. La maladie s’était déclarée chez les donneurs entre dix-sept mois et trois ans et demi après leur don. Depuis 2019, 232 cas de vMCJ ont été recensés dans douze pays, principalement au Royaume-Uni (178) et en France (28). Pour les cas recensés dans d’autres pays, on a pu établir qu’ils étaient liés à des séjours au Royaume-Uni ou dans d’autres pays important de la viande du Royaume-Uni (risque d’introduction de l’encéphalopathie spongiforme bovine par la chaîne alimentaire). Par conséquent, les risques de transmission de la vMCJ par des donneurs qui ont vécu ou ont reçu des transfusions sanguines dans une région à risque, mais qui ne montrent aucun signe de la maladie sont infimes.
Les directives de Santé Canada ne contiennent aucune information concernant la notification des rappels de produits aux transfusés. En revanche, la FDA précise dans un document d’orientation qu’elle ne juge pas approprié de rechercher et de prévenir les personnes ayant reçu des composants sanguins de donneurs ayant séjourné ou ayant été transfusés dans une région à risque pour la vMCJ (voir bibliographie).
Risque de MCJ classique
Les personnes ayant pris de l’hormone de croissance humaine ou de la gonadotrophine hypophysaire ou ayant des antécédents familiaux de MCJ sont exclues du don de sang. Il arrive que des donneurs nous informent qu’un membre de leur famille ou eux-mêmes sont atteints de la maladie ou ont omis de signaler un risque à cet égard lors de leur don.
Plus de 100 receveurs de composants sanguins provenant de donneurs touchés par la MCJ ont été suivis dans le cadre de deux vastes études de cohortes réalisées au Royaume-Uni et aux États-Unis. Depuis le début de ces études, il y a plus de dix ans, aucun signe de transmission de la maladie n’a été observé. La FDA dit, dans le document d’orientation cité dans la bibliographie, ne pas juger utile d’avertir les receveurs de composants sanguins issus de donneurs touchés par la MCJ ou dont un parent en est atteint.
Mononucléose (virus Epstein-Barr)
À titre de précaution, on procède au rappel de tous les composants recueillis dans les 30 jours précédant l’apparition de la mononucléose. La transmission du VEB a été observée chez des transfusés immunodéprimés, notamment à la suite d’une greffe. Le VEB étant lié aux lymphocytes B, la réduction leucocytaire systématique réduit nettement les risques de transmission. En outre, plus de 90 % des adultes étant porteurs chroniques de ce virus, la majorité des transfusés l’ont probablement déjà.
Variole du singe
La variole du singe (Mpox) a émergé en Afrique entre l’hiver et le printemps 2022. Aucun cas de variole du singe transmise par transfusion n’a été signalé, même si une transmission par cette voie est en théorie possible. En août 2022, la Société canadienne du sang a ajouté des questions sur la variole du singe pour l’admissibilité au don. Une exclusion de 42 jours à compter de l’apparition des symptômes est requise en cas d’infection. De même, un contact étroit au cours des six dernières semaines avec une personne ayant contracté la variole du singe nécessite une exclusion de 42 jours à compter du dernier contact. Par contact étroit, on entend un contact avec la peau, les fluides corporels ou un objet contaminé comme les vêtements, ainsi que tout contact direct sans masque pendant plus de trois heures. Un examen médical du donneur aura à chaque fois lieu après le don.
COVID-19 (virus SARS-CoV-2)
Malgré des millions de cas de COVID-19 dans le monde, la transmission par transfusion du SARS-CoV-2 n’a pas été démontrée. Plusieurs études suggèrent qu’il n’y a pas de transmission par cette voie ou que la survenue est si rare qu’elle n’a pas été détectée. À l’automne 2022, plus de 95 % des donneurs de la Société canadienne du sang étaient vaccinés et plus de 60 % avaient déjà contracté naturellement l’infection au SARS-CoV-2. Au cas où la Société canadienne du sang apprendrait après le don que le donneur a récemment contracté la COVID-19 (c.-à-d. apparition des symptômes dans les dix jours suivant le don), les composants seront retirés de la circulation. Aucun suivi supplémentaire de la personne transfusée n’est recommandé.
Pathologie virale
Par précaution, tous les composants sont rappelés si le donneur présente les symptômes de l’une des maladies ci-dessous dans les sept jours suivant le don. En théorie, le donneur était peut-être en phase de virémie lors du don, mais on ne recense, dans la réalité, que très peu de cas de transmission des virus en question, voire aucun.
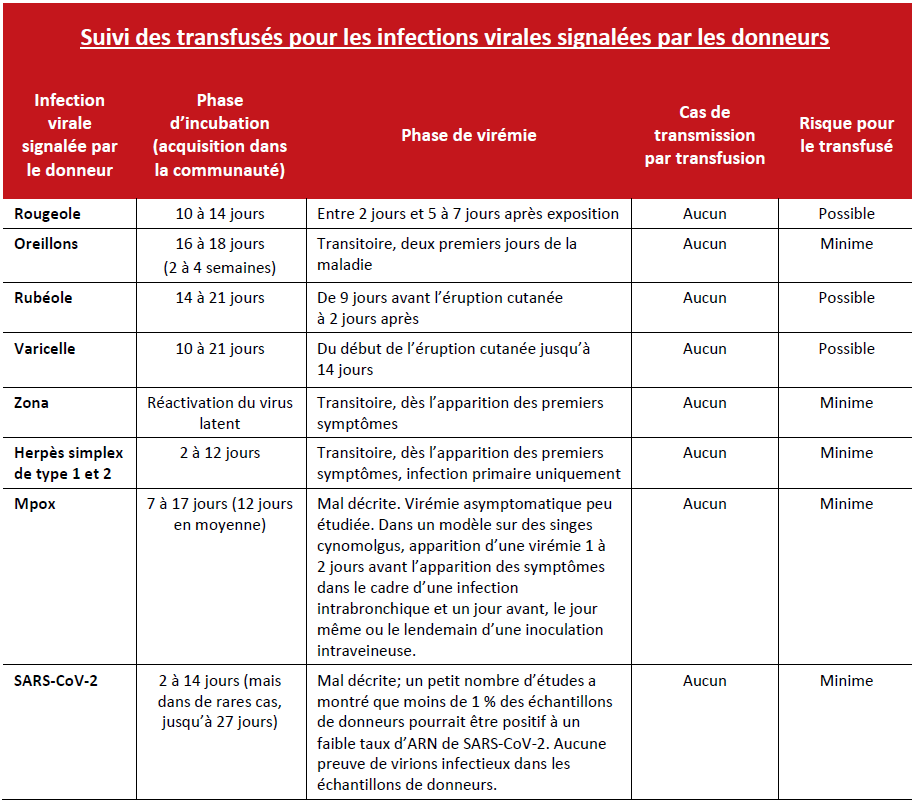
Infection par le virus Zika, confirmée en laboratoire
Il y a eu très peu de signalements d’infection au virus Zika possiblement transmise par transfusion, et dans les rares cas signalés, les receveurs étaient asymptomatiques. Il est important de savoir si le patient est une femme enceinte, car il est peu probable que le Zika représente un risque significatif pour toute autre catégorie de patients. Pour les femmes enceintes, il est recommandé de faire un suivi comprenant un test de dépistage du Zika.
PROBLÈMES DE FABRICATION
Tests BacT/Alert non valables
Il se peut que les tests n’aient pas été réalisés comme il se doit (échantillons prélevés moins de 36 heures après le don) ou qu’une défaillance technique ait invalidé les résultats des hémocultures BacT/ALERT. Lorsque les tests sur les composants plaquettaires n’ont pas été effectués correctement, le risque de contamination bactérienne augmente à environ 1 sur 10 000 (taux de cultures bactériennes réellement positives sur les plaquettes de la Société canadienne du sang).
Erreurs de documentation lors de la qualification des donneurs et de la production
Les erreurs contenues dans le dossier du don de sang ou commises durant la production sont souvent dues à l’omission de certains renseignements : signature et heure d’entreposage, par exemple. Les produits font alors l’objet d’un rappel, car de telles erreurs sont considérées comme une entorse aux bonnes pratiques de fabrication. Cependant, il est très peu probable que le produit présente plus de risques pour la transfusion.
Erreurs d’étiquetage
Les codes et les volumes des produits, ainsi que d’autres mentions figurant sur l’étiquette peuvent être erronés. Les produits font alors l’objet d’un rappel, car de telles erreurs sont considérées comme une entorse aux bonnes pratiques de fabrication. Le produit ne présente toutefois pas plus de risques pour la transfusion, sauf dans de très rares cas (si le groupe sanguin indiqué était erroné, par exemple).
Stérilité compromise
Des incidents tels que la fermeture imparfaite du contenant du composant sanguin risquent d’augmenter légèrement les risques de contamination bactérienne. Ces risques varient selon la nature du composant et du problème survenu.
Erreurs ou incohérences dans le phénotypage de l’antigène D ou des antigènes érythrocytaires
De telles erreurs peuvent avoir leur importance si le transfusé est immunisé contre l’antigène mal identifié. Ce serait le cas, par exemple, si l’on transfusait un produit contenant l’antigène Kell à un patient possédant des anti-K; une telle situation pourrait mener à une réaction hémolytique retardée. Si un patient devait recevoir un produit à antigène négatif pour éviter une allo-immunisation et qu’il recevait un produit identifié comme négatif par erreur, il pourrait fabriquer des anticorps. Des écarts peuvent être liés à de faibles sous-groupes d’antigènes A ou B ou à une expression faible ou partielle d’antigènes D.
Résultats du contrôle qualité ou numération leucocytaire inacceptables
Les produits dont la numération leucocytaire dépasse la limite stipulée dans la circulaire d’information de la Société canadienne du sang pourraient entraîner un plus grand risque de transmission du CMV. La transfusion de produits sanguins contenant du CMV à des patients séronégatifs, notamment à des personnes qui ont reçu une greffe de cellules souches allogéniques, peut avoir de très graves conséquences cliniques.
CONTAMINATION BACTÉRIENNE
Culture BacT/ALERT positive
Les composants sanguins doivent être rappelés si le système d’hémoculture BacT/ALERT indique une réaction positive. Un complément d’information doit suivre éventuellement les premiers résultats. L’investigation effectuée par la suite confirme, dans certains cas, la contamination bactérienne (résultat réellement positif) et révèle la nature de la bactérie. Dans d’autres, l’investigation révèle une réaction faussement positive. Si la prolifération de bactéries est plus fréquente dans les unités de plaquettes, des réactions septiques ont déjà été attribuées à des concentrés érythrocytaires et des composants congelés. La septicémie se manifeste généralement par de la fièvre, des frissons et une hypotension, durant la transfusion ou dans les quatre heures suivantes. Si l’on soupçonne une réaction, on procède à une inspection, à une coloration de Gram et à une culture sur le composant sanguin, s’il en reste. Une hémoculture sur le sang du patient peut également être indiquée, notamment si l’avis de rappel a été reçu juste après la transfusion ou si le patient a été pris de fièvre et de frissons après la transfusion.
Contamination ou possible contamination d’un composant connexe
Tous les composants issus d’un même don sont rappelés si la culture BacT/ALERT de l’un d’eux est positive ou si la Société canadienne du sang est informée que le receveur de l’un des composants a peut-être fait une réaction septique. Un complément d’information pourrait suivre, par exemple les résultats de nouvelles cultures ou la nature de la bactérie. Si les cultures bactériennes réalisées sur un mélange de plaquettes extraites de la couche leucoplaquettaire sont positives, tous les concentrés érythrocytaires et composants plasmatiques issus du même mélange doivent faire l’objet d’un rappel. Une très petite partie des composants connexes serait effectivement contaminée.
SYNDROME RESPIRATOIRE AIGU POST-TRANSFUSIONNEL
TRALI, risque accru
Des composants sanguins peuvent être rappelés si un autre composant issu du même don ou d’un autre don du même donneur est à l’origine d’un cas de TRALI.
La pathogénèse du TRALI est mal connue, mais l’on distingue plusieurs facteurs déclencheurs : la présence, dans le sang du donneur, d’anticorps anti-HLA ou anti-granulocytes dirigés contre les antigènes du receveur, le plasma contenu dans le produit et la pathologie sous-jacente du receveur. Les études menées sur les receveurs de composants sanguins provenant de donneurs manifestement touchés par un TRALI provoqué par des anticorps ont révélé une fréquence de complications pulmonaires et de TRALI légèrement plus élevée chez ces receveurs que dans la population générale des transfusés. Le TRALI ne touche cependant qu’une minorité de transfusés.
