Transfusion et cytomégalovirus dans le système d’approvisionnement en sang assuré par la Société canadienne du sang*
Gwen Clarke, M.D., co-présidente
Lani Lieberman, M.D.
Donna Wall, M.D.
Jutta Preiksaitis, M.D.
List of abbreviations
Cytomégalovirus
Cytomégalovirus transmis par transfusion
Immunoglobuline G
Comité consultatif national sur le sang et les produits sanguins
Concentrés de globules rouges
Transfusion intra-utérine
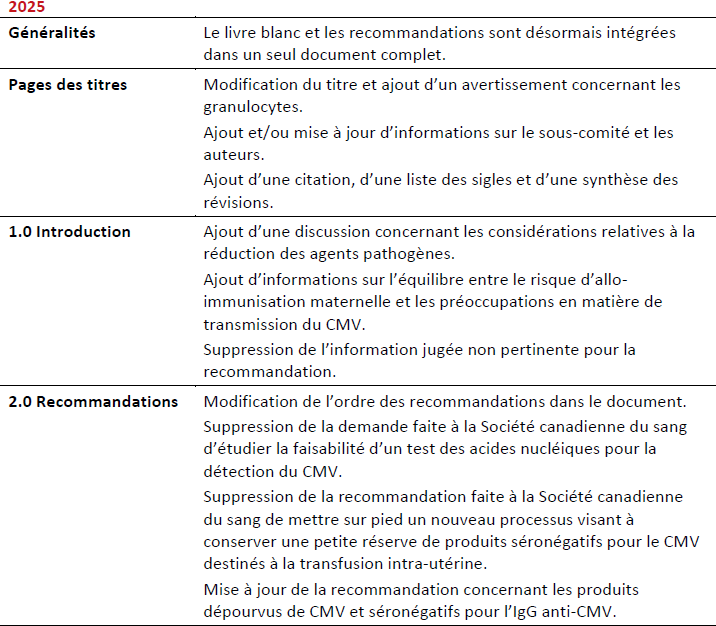
Summary of Revisions
Revision Date
Details
Le cytomégalovirus (CMV) est un virus herpétique dont la séroprévalence se situe entre 40 et 80 % dans la population générale et varie selon l’âge, l’origine géographique et le statut socioéconomique1-3. Le CMV se transmet par contact direct avec des tissus ou des sécrétions (sang, salive, urine ou lait maternel).4 Il demeure latent pendant des années dans les cellules mononucléaires et dans d’autres tissus, mais les personnes en bonne santé sont généralement asymptomatiques. Une infection par le CMV peut causer des complications graves chez les personnes immunodéprimées, comme la pneumonie interstitielle, l’hépatite, la rétinite et l’encéphalite. Il est possible de traiter et de prévenir efficacement une infection par le CMV chez la plupart des personnes à risque5.
Contrairement à d’autres virus transmissibles par transfusion, les dépistages effectués par les fournisseurs de sang dépendent des analyses sérologiques, car les méthodes actuelles de test des acides nucléiques ne sont pas autorisées pour le dépistage, et peuvent entraîner des résultats peu fiables ou irréguliers du fait de l’ADN libre du CMV dans des cellules non infectieuses6,7. Cela signifie que jusqu’à présent, les cliniciens qui demandent des unités « CMV négatives » au Canada reçoivent des composants provenant de donneurs ne possédant pas d’anticorps IgG détectables. Même si la fenêtre d’infection d’un donneur peut aller jusqu’à huit semaines8, le risque de transmission par voie transfusionnelle reste très faible, car les globules rouges et les composants plaquettaires déleucocytés avant l’entreposage présentent un risque significativement réduit de transmission du CMV et sont considérés comme sûrs du point de vue du cytomégalovirus pour la plupart des indications de transfusion. Les composants séronégatifs pour le CMV et les composants déleucocytés avant l’entreposage sont considérés équivalents en termes de prévention des infections par le CMV à la suite d’une transfusion (CMV-TT) et pour pratiquement toutes les indications. Veuillez noter que cela ne s’applique pas aux granulocytes produits par Héma-Québec. Pour des recommandations relatives aux granulocytes, il convient de consulter la documentation d’Héma-Québec et du Comité consultatif national de médecine transfusionnelle.
Les composants traités par psoralène et irradiation aux ultraviolets à des fins de réduction des agents pathogènes peuvent également être considérés comme sûrs en ce qui concerne le CMV. Les plaquettes mélangées traitées par psoralène sont offertes à la transfusion au Canada et sont dépourvues de CMV sans qu’il soit nécessaire de procéder à un test d’anticorps anti-CMV ou à une déleucocytation9.
Par le passé, il y a eu des cas d’infections à la suite d’une transmission du CMV par voie transfusionnelle, à des taux pouvant atteindre 60 % avec du sang total frais et chaud7. Cependant, les techniques actuelles de déleucocytation avant l’entreposage ont entraîné un fort déclin du taux de transmission, qui est aujourd’hui estimé à 1 sur 13 575 00010. En 2016, Maria Mainou et ses collègues ont procédé à une revue systématique et à une méta-analyse pour évaluer l’impact de la déleucocytation – avec ou sans analyses sérologiques du sang des donneurs – sur la réduction des risques d’infection par le CMV liés à la transfusion. Bien que la qualité de certaines études puisse soulever des préoccupations, aucune des onze études n’indiquait une augmentation des risques d’infection par le CMV (données cliniques ou résultats d’analyses de laboratoire) lors de la comparaison des unités déleucocytées aux unités non testées (n = 5); des unités déleucocytées aux unités séronégatives pour le CMV (n = 3) et des unités déleucocytées à des unités déleucocytées séronégatives pour le CMV (n = 2)11. De même, une publication de Mabilangan et ses collègues en 2020 a également établi la sécurité des composants déleucocytés sans dépistage supplémentaire du CMV chez des personnes immunodéprimées, dont le système immunitaire se rapproche peut-être plus précisément de celui des foetus.
En 2017, lorsque le CCN a publié son Document pédagogique du Comité consultatif national : Transfusion et cytomégalovirus dans le système canadien d'approvisionnement en sang, il a inclus des recommandations visant à continuer à privilégier les globules rouges et produits plaquettaires séronégatifs pour le CMV et déleucocytés pour l’indication de transfusion intrautérine (TIU). Depuis, des enquêtes internationales relatives aux composants sanguins utilisés pour les TIU ont confirmé que dans beaucoup de pays, les composants déleucocytés sont considérés comme sûrs du point de vue du CMV pour toutes les indications, TIU comprise, et ce, malgré une séroprévalence du CMV supérieure à celle observée au Canada13.
De plus, le besoin de globules rouges avec phénotype compatible pour les TIU s’oppose parfois au besoin de CGR séronégatifs pour le CMV. Pour les grossesses traitées par TIU, le risque d’allo-immunisation aux antigènes des CGR distincts de ceux de la femme enceinte s’élève à 14 % par TIU. Ce risque d’allo-immunisation est réduit à 4,3 % par TIU en cas d’utilisation d’unités avec compatibilité Rh, Kell, Kidd, Duffy et S14. Le consensus général dans le corps médical au Canada souligne la priorité à accorder à l’utilisation d’unités avec phénotype compatible plutôt qu’au statut de dépistage séronégatif pour le CMV pour les personnes recevant une transfusion intra-utérine.
Étant donné le profil de sécurité des globules rouges déleucocytés avant l’entreposage, les pratiques internationales ainsi que les données canadiennes qui établissent que les praticiens considèrent désormais les globules rouges déleucocytés avant l’entreposage comme la norme pour les TIU lorsqu’il est difficile de répondre aussi bien aux exigences de phénotypage que de séronégativité pour le CMV, le sous-comité du CCN sur le CMV a modifié ses recommandations comme suit.
En conséquence, le sous-comité du CCN sur le CMV a approuvé la recommandation mise à jour (en 2025) suivante :
Le Comité consultatif national recommande que les produits déleucocytés, c’est-à-dire dépourvus de CMV, et les produits séronégatifs pour l’IgG anti-CMV qui sont produits par la Société canadienne du sang soient considérés comme équivalents.
References
- Lancini DV, Faddy HM, Ismay S, Chesnau S, Hogan C, Flower RL. Cytomegalovirus in Australian blood donors: seroepidemiology and seronegative red blood cell component inventories. Transfusion. 2016 January 22; 56(6 Pt2):1616-21. Disponible sur le Web : https://onlinelibrary.wiley.com/doi/10.1111/trf.13459
- Roback JD. CMV and blood transfusions. Reviews in Medical Virology. 2002 Jul-Aug 12; 12(4):211-219. Disponible sur le Web : https://onlinelibrary.wiley.com/doi/10.1002/rmv.353
- Furui Y, Satake M, Hoshi Y, Uchida S, Suzuki K, Tadokora K. Cytomegalovirus (CMV) seroprevalence in Japanese blood donors and high detection frequency of CMV DNA in elderly donors. Transfusion. 2013 August 22; 53(10):2190-2197. Disponible sur le Web : https://doi.org/10.1111/trf.12390
- Bardanzellu F, Fanos V, Reali A. Human Breast Milk-acquired Cytomegalovirus Infection: Certainties, Doubts and Perspectives. Curr Pediatr Rev. 2019;15(1):30-41. Disponible sur le Web : https://doi.org/10.2174/1573396315666181126105812
- Meesing A, Razonable RR. New Developments in the Management of Cytomegalovirus Infection After Transplantation. Drugs. 2018 June 30; 78(11):1085–1103. Disponible sur le Web : https://doi.org/10.1007/s40265-018-0943-1
- Preiksaitis JK. Prevention of transfusion-acquired CMV infection: is there a role for NAT? Transfusion. 2003 March 12; 43(3):302-5. Disponible sur le Web : https://doi.org/10.1046/j.1537-2995.2003.00373.x
- Ziemann M, Krueger S, Maier AB, Unmack A, Goerg S, Henning H. High prevalence of cytomegalovirus DNA in plasma samples of blood donors in connection with seroconversion. Transfusion. 2007 August 02; 47(11):1972-83. Disponible sur le Web : https://doi.org/10.1111/j.1537-2995.2007.01420.x
- Drew WL, Tegtmeier GE, Alter HJ, Laycock ME, Miner RC, Busch MP. Frequency and duration of plasma CMV viremia in seroconverting blood donors and recipients. Transfusion. 2003 March 12; 43(3):309-13. Disponible sur le Web : https://doi.org/10.1046/j.1537-2995.2003.00337.x
- Circular of Information for the Use of Human Blood Components: Pathogen Reduced Platelet Concentrates. Ottawa: Canada, April 2023 [cited 2023 12 11]. Disponible sur le Web : https://www.blood.ca/sites/default/files/IM-00050_Revision_2.pdf
- Seed CR, Wong J, Polizzotto MN, Faddy H, Keller AJ, Pink J. The residual risk of transfusion transmitted cytomegalovirus infection associated with leucodepleted blood components. Vox Sang. 2015 July; 109(1):11-17. Disponible sur le Web : https://doi.org/10.1111/vox.12250
- Mainou M, Alahdab F, Tobian AA, et al. Reducing the risk of transfusion transmitted cytomegalovirus infection: a systematic review and meta-analysis. Transfusion. 2016 January 29; 56(6 Pt2):1569-80. Disponible sur le Web : https://doi.org/10.1111/trf.13478
- Mabilangan C, Burton C, Nahirniak S, O’Brien S, Preiksaitis J. Transfusion-transmitted and community-acquired cytomegalovirus infection in seronegative solid organ transplant recipients receiving seronegative donor organs. Am J Transplant 2020 Dec; 20(12):3509-3519. Disponible sur le Web : https://pubmed.ncbi.nlm.nih.gov/32428296/
- Clarke G, Bodnar M, Lozano M, et al. Vox Sanguinis International Forum on the selection and preparation of blood components for intrauterine transfusion: Summary. Vox Sang. 2020 May 12; 115(8):813-826. Disponible sur le Web : https://doi.org/10.1111/vox.12901
- Schonewille H, Prinsen-Zander KJ, Reijnart M, et al. Extended matched intrauterine transfusions reduce maternal Duffy, Kidd, and S antibody formation. Transfusion. 2015 July 14; 55(12):2912–2919. Disponible sur le Web : https://doi.org/10.1111/trf.13231
