Présentation générale sur la déclaration des réactions transfusionnelles indésirables à l’intention des hôpitaux au Canada
Alan Tinmouth, M.D.
Lakshmi Rajappannair, M.D.
Lucinda Whitman, M.D.
Membres spéciaux :
Mohammad Afzal (ASPC)
Maria Faraci, M.D. (Santé Canada)
Gilles Lambert, M.D. (SHQ/INSPQ)
Marianne Lavoie, M.D. (SHQ/INSPQ)
Jessica Leung, Pharm. D. (Santé Canada)
Pierre-Aurèle Morin, M.D. (CCNMT)
Joanne Nixon (SSIT Ontario)
Andréanne Trottier (CCNMT, MSSS)
Jun Wu, M.D., Ph. D. (ASPC)
Matthew Yan, M.D. (Société canadienne du sang)
List of abbreviations
Agence de la santé publique du Canada
Comité consultatif national en médecine transfusionnelle
Comité consultatif national sur le sang et les produits sanguins
Formulaire de déclaration des événements indésirables liés aux transfusions au Canada
Héma-Québec
Incident lié aux instruments médicaux
Institut national de santé publique du Québec
Laboratoire de médecine transfusionnelle
Ministère de la Santé et des Services sociaux
Programme Canada Vigilance
Programme de contributions pour la sûreté du sang
Rapport d’événement indésirable associé à la transfusion
Réaction indésirable à un médicament
Réaction transfusionnelle indésirable
Réseau canadien de renseignements sur la santé publique
Société canadienne du sang
Surcharge circulatoire liée à la transfusion
Syndrome respiratoire aigu post-transfusionnel
Système de surveillance des erreurs transfusionnelles
Système de surveillance des incidents transfusionnels
Système d’hémovigilance du Québec
Summary of Revisions
Revision Date
Details

Accident. Événement imprévu qui n’est pas imputable à une inobservation des procédures opératoires normalisées ou des règles de droit en vigueur et qui pourrait compromettre la santé et la sécurité humaines ou la sécurité du sang.^
Agrégat. Ensemble de cas plus nombreux qu’attendu en un lieu et une période de temps donnés (par exemple, augmentation de la fréquence des réactions prévues ou imprévues, quelle que soit leur gravité, présumées associées à un lot de produits sanguins en particulier).
Note : Cette définition est tirée du manuel Field Epidemiology (2002) (en anglais), car les organisations déclarantes ne proposent actuellement aucune définition du terme « agrégat ».
Composant sanguin. Composant thérapeutique du sang humain destiné à être transfusé à un receveur et préparé par un fournisseur de sang.
• Les composants sanguins incluent le sang total, les globules rouges, les granulocytes, les plaquettes (y compris les plaquettes à teneur réduite en agents pathogènes fabriquées par les fournisseurs de sang), le plasma et le cryoprécipité.
Erreur^. Inobservation des procédures opératoires normalisées ou des règles de droit en vigueur et qui pourrait compromettre la sécurité humaine ou la sécurité du sang.
Établissement de sang^. Personne ou hôpital qui réalise l’une des activités suivantes en lien avec le sang :
• Importation;
• Traitement;
• Distribution;
• Transformation (irradiation, dissociation, lavage, mise en commun, etc.);
• Transfusion.
Formulaire de déclaration des événements indésirables liés aux transfusions au Canada (FDEITC). Formulaire national normalisé à utiliser par les hôpitaux pour déclarer au SSIT du PCSS tout événement indésirable résultant d’un incident (erreur ou accident) ou toute réaction transfusionnelle.
Fournisseur de sang. Sous-ensemble d’établissements de sang qui collectent, traitent et distribuent le sang. La Société canadienne du sang et Héma-Québec sont les deux seuls fournisseurs de sang au Canada.
Hémovigilance. Procédures de surveillance couvrant l’ensemble de la chaîne transfusionnelle, depuis la collecte du sang (composants) jusqu’au suivi des receveurs. Ces procédures évaluent les informations relatives aux effets ou réactions indésirables à une transfusion en vue de prévenir leur apparition.
Note : Cette définition vient du Groupe de travail sur l’hémovigilance de la Société internationale de transfusion sanguine (en anglais), car les organisations déclarantes ne proposent actuellement aucune définition du terme « hémovigilance ».
Incident lié aux instruments médicaux (IIM)#. Incident lié à la défaillance d’un instrument médical ou à la dégradation de son efficacité, ou à un étiquetage ou un mode d’emploi inadéquat ayant entraîné la mort ou une grave détérioration de l’état de santé d’un patient, d’un utilisateur ou de toute autre personne, ou qui pourrait avoir cet effet s’il se reproduisait. Pour plus de détails, consultez le Document d’orientation du Programme Canada Vigilance de Santé Canada.
Produit sanguin. Produit dérivé du plasma humain par fractionnement et autorisé par Santé Canada (par exemple, produit sanguin avec un DIN; également appelé protéine plasmatique, dérivé du plasma, produit sanguin fractionné). Ces produits sont inclus dans la définition du terme « médicament » dans le contexte de la Déclaration des effets indésirables graves de Canada Vigilance de Santé Canada.
• Parmi les produits sanguins avec un DIN, on retrouve les immunoglobulines, l’albumine, les concentrés de facteur de coagulation et le plasma traité au solvant-détergent.
Note : Les thérapies non dérivées du plasma (par exemple, les concentrés de facteur de coagulation recombinants et les thérapies hémostatiques pharmaceutiques) parfois proposées par les fournisseurs de sang sont également incluses dans la définition du terme « médicament » dans le contexte de la Déclaration des effets indésirables graves de Canada Vigilance de Santé Canada.
Programme Canada Vigilance (PCV). Programme de surveillance après la mise en marché de Santé Canada qui recueille et évalue les déclarations d’effets indésirables présumés associés aux produits de santé commercialisés au Canada.
Programme de contributions pour la sûreté du sang (PCSS). Programme relevant de l’Agence de la santé publique du Canada qui appuie les activités de surveillance en ce qui concerne les effets indésirables liés au sang, aux cellules, aux tissus et aux organes, dans le but de veiller à la sécurité du système de santé canadien. Le PCSS combine :
• le Système de surveillance des incidents transfusionnels (SSIT);
• le Système de surveillance des erreurs transfusionnelles (SSET);
• le Système de surveillance des cellules, des tissus et des organes.
Pour plus de détails, visitez la page Web du Programme de contributions pour la sûreté du sang.
Réaction indésirable grave à un médicament#. Comme définie à la Partie C, Titre 1, sous-section C.01.001(1.1) du Règlement sur les aliments et drogues et aux fins de la Loi sur les aliments et drogues, réaction nocive et non intentionnelle à un médicament (y compris un produit sanguin avec un DIN) qui est provoquée par toute dose de celle-ci et qui :
• Nécessite l’hospitalisation;
• Prolonge l’hospitalisation;
• Entraîne une malformation congénitale;
• Entraîne une invalidité ou incapacité persistante ou importante;
• Met la vie en danger; ou
• Entraîne la mort.
Note : Outre les critères de gravité ci-dessus, Santé Canada encourage les hôpitaux à déclarer les réactions indésirables aux médicaments, y compris celles aux produits sanguins, qui ont entraîné des événements médicaux importants. Les événements médicaux importants peuvent ne pas mettre immédiatement la vie en danger ni entraîner immédiatement la mort ou l’hospitalisation, mais peuvent mettre le patient en péril et nécessiter une intervention (par exemple, un séjour au service des urgences ou à une clinique de soins d’urgence) pour prévenir l’apparition de l’une des conséquences graves susmentionnées.
Réaction transfusionnelle indésirable (RTI). Réaction indésirable et imprévue à l’administration de sang (y compris de composants sanguins et de produits sanguins), dont l’imputabilité avec ces produits est jugée certaine, probable ou possible. Une RTI peut être grave ou non grave (voir les définitions ci-dessous).
Réaction transfusionnelle indésirable grave. Réaction indésirable qui entraîne l’une des conséquences suivantes chez le receveur des composants sanguins ou des produits sanguins transfusés :
• Nécessité d’une hospitalisation ou d’une prolongation de l’hospitalisation directement imputable à l’événement;
• Invalidité ou incapacité persistante ou importante;
• Nécessité d’une intervention médicale ou chirurgicale pour empêcher un dommage permanent ou important ou une déficience corporelle;
• Mise en danger de la vie;
• Mort.
Cette définition inclut les réactions de niveau 2, 3 et 4 définies dans le manuel de l’utilisateur du SSIT.
Réaction transfusionnelle indésirable non grave. Réaction indésirable à la transfusion d’un composant sanguin ou d’un produit sanguin qui ne correspond pas à la définition d’une réaction transfusionnelle ou médicamenteuse indésirable grave. Cette définition inclut les réactions de niveau 1 définies dans le manuel de l’utilisateur du SSIT.
Les définitions marquées d’un ^ sont tirées du Règlement sur le sang du gouvernement du Canada (DORS/2013-178).
Les définitions marquées d’un # sont tirées du Document d’orientation – Déclaration obligatoire des réactions indésirables graves à un médicament et des incidents liés aux instruments médicaux par les hôpitaux de Santé Canada, gouvernement du Canada (2019-06-26).
Le présent document vise à fournir aux hôpitaux une ressource qui récapitule les méthodes de déclaration des réactions transfusionnelles indésirables (RTI) au Canada. Ce document ne couvre pas les détails liés à la déclaration des erreurs et des accidents transfusionnels.
L’hémovigilance est importante pour renforcer la sécurité globale du système d’approvisionnement en sang et de la transfusion pour les receveurs. Elle exige des hôpitaux de déclarer les cas présumés graves ou inattendus de RTI dus à la transfusion d’un composant sanguin (globules rouges, plaquettes, plasma, etc.) ou d’un produit sanguin (immunoglobuline intraveineuse, concentrés de complexe prothrombique, immunoglobuline anti-Rh, albumine, plasma traité au solvant-détergent, etc.), de réaliser une enquête subséquente sur la cause de RTI et d’appliquer toute recommandation.
À la suite de la détection et de la gestion aiguë d’une RTI chez un receveur de transfusion, un avis formel de RTI est transmis par l’équipe clinique au laboratoire de médecine transfusionnelle (LMT, ou banque de sang), conformément aux politiques et procédures de l’hôpital. Une fois l’avis de RTI reçu, les professionnels de santé de l’hôpital enquêtent sur le cas présumé de RTI, conformément aux pratiques de la province ou du territoire. Parmi les professionnels de la santé responsables de l’enquête sur les circonstances de la RTI et de la transmission du compte rendu aux autorités pertinentes se trouvent les agents de sécurité transfusionnelle ou les infirmières de sécurité transfusionnelle, les technologues de laboratoires médicaux, les agents d’assurance de la qualité ou les médecins spécialisés en médecine transfusionnelle au sein des services de médecine transfusionnelle de l’hôpital.
Au Canada, deux organisations nationales de la santé reçoivent les données sur les réactions transfusionnelles indésirables des services de médecine transfusionnelles des hôpitaux :
- Le Programme Canada Vigilance (PCV) de Santé Canada, qui reçoit les rapports des établissements de sang canadiens, dont les fournisseurs de sang et les hôpitaux, et ce, conformément aux exigences du Règlement sur le sang fédéral et du Règlement sur les aliments et drogues;
- L’Agence de la santé publique du Canada (ASPC), qui gère le système de surveillance des incidents transfusionnels (SSIT).
Le SSIT de l’ASPC et le PCV de Santé Canada font partie du portefeuille de la Santé du Canada, mais ont chacun des objectifs et des systèmes de déclaration différents.
Actuellement, le PCV de Santé Canada et le SSIT de l’ASPC n’ont pas de base de données commune, les données des deux programmes provenant de sources différentes. Les déclarations de réactions indésirables graves que reçoit le PCV de Santé Canada viennent principalement des fournisseurs de sang (Société canadienne du sang et Héma-Québec) en vertu du Règlement sur le sang, tandis que les déclarations reçues par le SSIT proviennent des établissements de transfusion de sang à l’échelle provinciale ou territoriale.
2.1 Santé Canada et le Programme Canada Vigilance (PCV)
L’hémovigilance est mandatée sur le plan fédéral par l’organisme de réglementation Santé Canada, en application du Règlement sur le sang et du Règlement sur les aliments et drogues pour le compte du ministère fédéral de la Santé.
Le PCV est un programme de surveillance après la mise en marché géré par Santé Canada. Le PCV recueille et évalue les déclarations de réactions indésirables présumées associées aux produits de santé (notamment les enquêtes sur les RTI).
Les professionnels de la santé et les consommateurs effectuent leurs déclarations sur une base volontaire, tandis que les fabricants, les distributeurs et les hôpitaux sont tenus de faire des déclarations en vertu du Règlement sur les aliments et drogues et du Règlement sur le sang.
L’un des objectifs clés du PCV de Santé Canada est d’assurer la sécurité de l’approvisionnement en sang par la collecte et l’analyse des déclarations de RTI en lien avec la qualité des composants sanguins ou des produits sanguins. Plus particulièrement :
- Les RTI associées aux composants sanguins sont pour la plupart déclarées au PCV de Santé Canada par les fournisseurs de sang (Société canadienne du sang et Héma-Québec);
- Les RTI associées aux produits sanguins sont déclarées au PCV de Santé Canada par les hôpitaux.
Note : Ce sont les membres du personnel des laboratoires de médecine transfusionnelle qui sont responsables de faire les déclarations au sein des hôpitaux et c’est à Santé Canada que revient la réglementation des hôpitaux qui transfusent du sang, et non aux autorités de santé régionales.
2.1.1 Blood Regulations
Le Règlement sur le sang vise à promouvoir et protéger la sécurité du sang prélevé au Canada et destiné à être transfusé ou transformé en médicament pour usage humain. Le Règlement sur le sang est administré par la Direction générale des produits de santé et des aliments de Santé Canada (une entité distincte de l’ASPC). Il inclut des exigences pour la sécurité humaine et la sécurité du sang quant aux activités suivantes en lien avec le sang humain et les composants sanguins destinés à être transfusés ou traités* :
- Transformation (irradiation, fractionnement, lavage, mise en commun, etc.);
- Étiquetage;
- Conservation;
- Tenue d’archives;
- Importation;
- Distribution;
- Enquêtes et déclarations sur les erreurs, les accidents et les réactions indésirables.
*Il convient de noter que le traitement inclut l’évaluation de l’adéquation du donneur, la collecte, l’analyse et la préparation du composant sanguin.
Le Règlement sur le sang est entré en vigueur en octobre 2014. Tous les établissements transfusionnels sont censés identifier et déclarer les RTI graves. C’est à l’organisation qui a réalisé l’activité ou les activités imputables qu’il incombe de faire la déclaration au PCV de Santé Canada et de mener l’intégralité de l’enquête. Dans la plupart des cas, ce sont les fournisseurs de sang qui sont responsables, soit la Société canadienne du sang ou Héma-Québec.
Dans de rares cas, les banques de sang des hôpitaux peuvent être chargées de l’enquête, en particulier si elles ont réalisé une activité de transformation sur le sang concerné.
S’il est déterminé que la RTI grave est imputable à la qualité ou à la sécurité du composant sanguin reçu du fournisseur de sang (Héma-Québec au Québec, la Société canadienne du sang pour les autres provinces et territoires), l’hôpital doit immédiatement soumettre une déclaration au fournisseur de sang, qui sera ensuite responsable de l’enquête et de la déclaration au PCV de Santé Canada. La déclaration doit être faite dans les 24 heures une fois que le déclarant a des motifs raisonnables de suspecter qu’un décès est en lien avec la qualité et la sécurité du produit transfusé; sinon, elle doit être faite dans les 15 jours calendaires. Voir l’annexe 1 et l’annexe 2A pour plus de détails.
Note : La déclaration des erreurs et des accidents liés aux composants sanguins ne relève pas de ce document. Pour plus d’informations sur les erreurs et les accidents, consulter les articles 103 à 108 de la Ligne directrice : Règlement sur le sang.
2.1.2 Déclaration obligatoire et Loi sur les aliments et drogues : Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa)
La Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa) a reçu la sanction royale le 6 novembre 2014 et est entrée en vigueur le 16 décembre 2019.
La Loi sur les aliments et drogues a été amendée par la Loi de Vanessa, qui a amélioré la capacité de Santé Canada à recueillir des renseignements sur l’innocuité d’un produit après sa mise sur le marché et à prendre les mesures appropriées en cas de risque grave pour la santé. Plusieurs modifications majeures ont été apportées à la Loi sur les aliments et drogues, dont l’introduction de la déclaration obligatoire des réactions indésirables graves et des incidents liés aux instruments médicaux par les établissements de soins de santé.
Depuis le 16 décembre 2019, les hôpitaux sont devenus de nouvelles parties réglementées qui sont tenues de déclarer les réactions transfusionnelles indésirables graves et les incidents liés aux instruments médicaux au PCV de Santé Canada dans les 30 jours calendaires suivant la consignation de l’événement à l’hôpital.
Les exigences de déclaration obligatoire s’appliquent, sans se limiter, aux produits thérapeutiques suivants réglementés en vertu du Règlement sur les aliments et drogues et du Règlement sur les instruments médicaux :
- Les médicaments biologiques, dont les produits sanguins fractionnés (protéines plasmatiques);
- Les médicaments, dont les produits non dérivés du plasma disponibles auprès des fournisseurs de sang;
- Les instruments médicaux, en particulier les défaillances des instruments médicaux liées aux procédures de transfusion de sang. Par instruments médicaux, on entend par exemple les réchauffeurs de sang et les instruments de perfusion sanguine.
Le Document d’orientation sur la déclaration obligatoire des réactions indésirables graves à un médicament et des incidents liés aux instruments médicaux par les hôpitaux fournit d’autres informations, notamment :
- Section 3 : Rôles et responsabilités
- Tous les hôpitaux réglementés par des lois provinciales ou territoriales et les hôpitaux exploités par le gouvernement fédéral qui fournissent des services de santé aux patients sont tenus de satisfaire aux exigences de déclaration obligatoire. L’exigence de déclaration obligatoire s’applique à l’établissement, c’est-à-dire à l’hôpital, et non aux professionnels de la santé qui y travaillent ni aux services de l’hôpital. Bien que les professionnels de la santé jouent un rôle important dans la détection et la consignation des réactions indésirables graves à un médicament et des incidents liés aux instruments médicaux, c'est à l’hôpital qu’il incombe de déterminer des responsabilités et des rôles internes clairs pour ses employés ou pour les travailleurs/entreprises/banques de sang en sous-traitance afin de se conformer à l’obligation de déclaration. Le personnel de l’hôpital doit bien connaître les procédures de déclaration des réactions indésirables graves à une transfusion ou à un médicament et des incidents liés aux instruments médicaux applicables dans leurs établissements.
- Section 5.2 : Exemples de réactions indésirables graves à un médicament, notamment les produits sanguins fractionnés (protéines plasmatiques).
- Section 6 : Exigences en matière de renseignements pour les déclarations de réactions indésirables graves à un médicament et les déclarations d’incidents liés aux instruments médicaux
- Certains éléments sont obligatoires dans les déclarations de réactions indésirables graves à un médicament (produit sanguin) et les déclarations d’incidents liés aux instruments médicaux. Consulter la Section 6 du Document d’orientation pour avoir la liste des données requises.
Note : Les hôpitaux sont encouragés à envoyer une copie de la déclaration au fabricant, qui est tenu par le Règlement sur les aliments et drogues de déclarer les réactions indésirables graves à un médicament à Santé Canada. Voir l’annexe 1 et l’annexe 2B pour plus de détails.
2.2 Agence de la santé publique du Canada (ASPC) : le Système de surveillance des incidents transfusionnels (SSIT)
En réponse à la Commission d’enquête sur le système d’approvisionnement en sang au Canada de 1997, le gouvernement fédéral a lancé une série de programmes et accordé des fonds pour améliorer la sécurité du système d’approvisionnement en sang du Canada. Le Programme de contributions pour la sûreté du sang (PCSS) de l’ASPC appuie l’élaboration et/ou l’amélioration des systèmes provinciaux et territoriaux qui surveillent les événements indésirables associés à la transfusion et à la transplantation. Lancé en 1999, le SSIT est l’un des trois réseaux de surveillance du PCSS.
Le SSIT est un système de surveillance national pour la déclaration des réactions indésirables au sang, aux composants sanguins ou aux produits sanguins (dérivés du plasma). Le principal objectif du SSIT est de surveiller les taux et les tendances des incidents de réactions transfusionnelles indésirables et de mieux connaître le risque que de telles réactions se produisent au Canada. La déclaration au SSIT se fait sur une base volontaire.
Le SSIT est conçu pour recueillir des données sur toutes les réactions transfusionnelles indésirables qui se produisent dans un établissement de transfusion, quelle qu’en soit la gravité et peu importe la relation de la réaction à la qualité du sang. Chaque province ou territoire recueille les déclarations de RTI, qui sont saisies par le personnel de l’hôpital dans la base de données nationale du SSIT via une plateforme centrale Web de l’ASPC connue sous le nom de Réseau canadien de renseignements sur la santé publique (RCRSP). Cependant, les données soumises au SSIT au cours de la dernière décennie incluaient majoritairement des réactions modérées et sévères (graves); certaines provinces n’ont pas systématiquement inclus dans leurs déclarations les données sur les RTI mineures (réactions fébriles non hémolytiques, réactions allergiques, etc.).
Le SSIT a été lancé comme projet pilote dans quatre provinces (Colombie-Britannique, Québec, Nouvelle-Écosse et Île-du-Prince-Édouard) et inclut des données sur les RTI pour la période 2001-2002. Dans la foulée de la réussite de ce projet pilote, le SSIT est devenu un système national en 2012, impliquant toutes les provinces et tous les territoires. Le Québec continue à maintenir un système d’hémovigilance provincial exhaustif. Les hôpitaux du Québec déclarent leurs données sur les RTI au SHQ, qui déclare annuellement toutes les RTI certaines, probables et possibles à la base de données du SSIT. En 2020, le taux de participation au SSIT des hôpitaux fournissant des services de transfusion au Canada était supérieur à 95 %.
Les comptes rendus nationaux du SSIT sont consultables en lignes sur la page Web de l’ASPC Publications – Médicaments et produits de santé, à la section Produits sanguins.
2.2.1 Déclaration des RTI au SSIT
Le SSIT a été instauré par le gouvernement fédéral, à titre de recommandation de la Commission Krever, pour améliorer l’innocuité du système d’approvisionnement en sang du Canada.
Un formulaire de déclaration des événements indésirables liés aux transfusions au Canada (FDEITC) et un manuel de l’utilisateur du SSIT ont été élaborés par un groupe de travail national du SSIT composé de représentants des provinces et des territoires, de fabricants de composants sanguins, de Santé Canada et de membres du personnel de l’ASPC. Le manuel de l’utilisateur du SSIT sert de ressource pour remplir le FDEITC ou la base de données du SSIT.
Les provinces et les territoires sont tenus de téléverser leurs données annuelles sur les RTI dans le système du RCRSP dans les six mois suivant la fin de l’année calendaire. Par exemple, les données de janvier à décembre 2020 doit être déclarées au plus tard en juin ou juillet 2021, et ainsi de suite.
Un groupe de travail composé d’experts dans leur province ou territoire respectif examinent les conclusions préliminaires de leurs données annuelles pour repérer les éventuelles erreurs ou omissions. Après la vérification des données, les rapports préliminaires du SSIT sont générés au niveau national.
En raison des restrictions de ressources humaines en milieu hospitalier, toutes les provinces et tous les territoires n’ont pas pu fournir de données exhaustives sur les réactions mineures de niveau 1, dont les réactions fébriles non hémolytiques et les réactions allergiques mineures, ainsi que les réactions transfusionnelles sérologiques retardées (nouveaux alloanticorps). Afin d’assurer l’uniformité des déclarations de RTI au sein des provinces et des territoires, et afin de faciliter la comparaison internationale des taux de RTI, l’ASPC continue à recommander de déclarer toutes les RTI dans la base de données du RCRSP.
Les détails des signes et symptômes de toutes les RTI sont disponibles dans la base de données du RCRSP et dans le manuel de l’utilisateur du SSIT.
Afin de maintenir la cohérence des déclarations de RTI au Canada, on encourage l’utilisation des définitions des RTI énoncées dans le manuel de l’utilisateur du SSIT. L’ASPC est consciente que le FDEITC et le manuel de l’utilisateur du SSIT datent de 2007.
Le milieu de la transfusion milite pour une mise à jour intérimaire des définitions des réactions transfusionnelles indésirables sur la base des nouvelles définitions officielles de la documentation existante. Dans l’hypothèse d’une mise à jour intérimaire ou de la révision du manuel de l’utilisateur du SSIT, ces ressources seront publiées sur le site Web de l’ASPC. L’ASPC communiquera immédiatement la publication de ces ressources aux parties prenantes.
Au Québec, l’Institut national de santé publique du Québec (INSPQ) a publié un Guide de déclaration des événements indésirables associés à la transfusion qui inclut de nouvelles définitions des RTI reflétant la documentation actuelle. Le SHQ encourage l’utilisation du guide de l’INSPQ au Québec qui est, présentement, le seul document existant en français.
2.3 Fournisseurs de sang du Canada : déclaration des RTI à la Société canadienne du sang ou à Héma-Québec
Les exigences de déclaration des RTI associées aux composants sanguins auprès des fournisseurs de sang (Société canadienne du sang et Héma-Québec) sont énoncées dans le Règlement sur le sang. Elles incluent les RTI graves ou inattendues lorsqu’on suspecte un problème de sécurité du composant sanguin et/ou lorsque les premières enquêtes laissent entendre une possible imputation à une activité réalisée par le fournisseur de sang. Les fournisseurs de sang réaliseront une enquête et déclareront les RTI applicables directement à Santé Canada. Une déclaration séparée de l’hôpital au PCV de Santé Canada n’est pas nécessaire, à moins que la RTI ne soit imputée à une activité réglementée réalisée à l’hôpital, comme mentionné à la section 2.1.
Les déclarations initiales au fournisseur de sang doivent au moins inclure le type de réaction présumée et les numéros d’unité du composant impliqué. Les autres informations décrites dans la Ligne directrice : Règlement sur le sang provenant de l’enquête de l’hôpital, dont les résultats des analyses et les renseignements cliniques pertinents sur le receveur, doivent être transmises au fournisseur de sang dès qu’elles sont disponibles. Tout formulaire de déclaration de RTI local ou provincial peut être utilisé pour déclarer une RTI au fournisseur de sang.
Voici quelques exemples de RTI à déclarer au fournisseur de sang :
- Réaction allergique sévère ou anaphylaxie;
- Syndrome respiratoire aigu post-transfusionnel (TRALI);
- Réaction post-transfusionnelle du greffon contre l’hôte;
- Contamination bactérienne;
- Infections transmises par transfusion;
- Réactions transfusionnelles hémolytiques directement imputables à l’étiquetage du produit (erreur de phénotype, désignation de faibles titres d’anticorps anti-A et anti-B, etc.).
Dans le cas d’une RTI associée à des composants sanguins recueillis par un autre fournisseur de sang en dehors de votre province ou territoire, veuillez demander conseil au fournisseur de sang de votre région.
Pour d’autres détails sur la déclaration des RTI aux fournisseurs de sang du Canada, veuillez consulter les ressources suivantes :
- Provinces du Canada (à l’exception du Québec) : Déclaration des réactions transfusionnelles indésirables
- Ligne directrice : Règlement sur le sang
- Québec : Publication de l’Institut national de santé publique du Québec, Guide de déclaration des événements indésirables associés à la transfusion de produits sanguins.
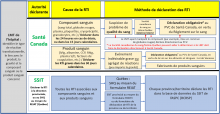
| Autorité déclarante | Formulaire |
|---|---|
|
SSIT de l’ASPC - RTI avec signes et symptômes, en précisant le lien/la gravité/le résultat, pendant ou après les transfusions de sang. |
Télécopiez le formulaire dépersonnalisé de déclaration des RTI de votre province ou territoire ou un Formulaire de déclaration des événements indésirables liés aux transfusions au Canada (FDEITC) dûment rempli au représentant local ou provincial/territorial du SSIT pour qu’il saisisse les données dans le RCRSP.
|
|
PCV de Santé Canada - RTI graves ou inattendues en lien avec la qualité/la sécurité du composant sanguin. |
Pour déclarer des RTI graves ou inattendues en lien avec la qualité/la sécurité d’un composant sanguin :
|
|
PCV de Santé Canada - Tendances/agrégats de RTI non graves (mineures) associées à des produits sanguins. |
Pour déclarer des tendances/agrégats de RTI non graves (mineures) associées à des produits sanguins :
Note : Si vous avez des questions d’ordre général sur le sang ou si vous suspectez un problème associé à un lot (agrégats potentiels de réactions graves ou non graves), vous pouvez écrire à canada.vigilance.blood-sang@hc-sc.gc.ca avant de soumettre le formulaire de déclaration. Merci de n’envoyer à cette adresse courriel aucune copie de déclaration contenant des renseignements sur un patient. |
|
PCV de Santé Canada - RTI grave associée à un produit sanguin; |
Pour déclarer des RTI graves associées à un produit sanguin ou des incidents liés aux instruments médicaux :
|
|
Santé Canada - Erreurs et accidents impliquant des composants sanguins (en vertu du Règlement sur le sang). |
Pour les erreurs et les accidents impliquant des composants sanguins (en vertu du Règlement sur le sang) :
Notes:
|
|
Société canadienne du sang |
Télécopiez le formulaire dûment rempli au centre de distribution des opérations de la Société canadienne du sang le plus proche de chez vous. |
|
Héma-Québec |
|
|
Fabricant de produits |
Un formulaire dépersonnalisé de déclaration des RTI de votre province ou territoire. Note : Une liste des numéros de télécopie et de téléphone des fabricants de produits est disponible à l’adresse https://www.blood.ca/. Pour obtenir les coordonnées, suivez le chemin suivant :
|
|
1Lorsque vous transmettez un formulaire de déclaration de RTI de votre province à la Société canadienne du sang ou au PCV, retirez toutes les informations permettant d’identifier un patient pour que seuls la date de naissance, le sexe et la date de transfusion du patient soient déclarés. 2La plateforme de déclaration en ligne vous permet d’accéder au bon formulaire de déclaration à envoyer au PCV de Santé Canada. Sélectionnez le produit suspecté (médicament ou instrument médical), puis la catégorie de rapporteur qui vous décrit le mieux (professionnel de la santé ou hôpital). |
Pour obtenir la liste de toutes les coordonnées des bureaux provinciaux et territoriaux et des organisations déclarant les RTI à l’échelle nationale, veuillez consulter le Supplément de ce document.
En complément des annexes à la fin de ce document, le lien suivant mène à un portail interactif utile pour prendre des décisions en lien avec la déclaration de RTI : https://redcap.link/CanadianWHOtoreportTransfusionReactionAlgorithm
Dans son rapport de 1997, le juge Krever mettait l’accent sur l’importance de la surveillance et du suivi des composants et des produits sanguins destinés à la transfusion, se référant au concept de gestion du sang « veine à veine ».
Le milieu de la médecine transfusionnelle au Canada reconnaît le besoin continu d’un système d’hémovigilance qui non seulement facilite la collecte de données sur les RTI, mais assure également une communication plus rapide des taux nationaux de RTI. Comme le montre l’exemple fourni par les rapports annuels publiés par le programme d’hémovigilance du Royaume-Uni Serious Hazards of Transfusion (SHOT), ces informations augmentent la sensibilisation à la sécurité de la transfusion et fournissent des recommandations pour améliorer les soins et la sécurité des patients quant à la transfusion de composants sanguins et de produits sanguins.
Un système d’hémovigilance efficace implique notamment :
- Une collaboration et une mise en commun des données à l’échelle intergouvernementale;
- La déclaration rapide et exacte des données en matière de RTI;
- Des systèmes de gestion des données et des banques de données disposant de ressources suffisantes;
- Un système électronique unifié de déclaration nationale des RTI permettant d’éliminer la déclaration en double dans plusieurs systèmes et d’améliorer l’intégrité des données d’hémovigilance;
- Des mécanismes cohérents de collecte des données d’émission sur les composants sanguins et les produits sanguins à partir des services de médecine transfusionnelle afin d’assurer une capture de données exactes pour la déclaration des taux de RTI.
Le rapport d’audit récemment publié par le PCSS intitulé Évaluation du Programme de contributions pour la sûreté du sang de l’Agence de la santé publique du Canada de 2017-2018 à 2021-2022 inclut des recommandations et un plan d’action documenté visant à renforcer le PCSS et son rôle important dans l’hémovigilance au Canada.
References
Programme Canada Vigilance : https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/medeffet-canada/programme-canada-vigilance.html
Ligne directrice : Règlement sur le sang : https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/produits-biologiques-radiopharmaceutiques-therapies-genetiques/information-demandes-presentations/lignes-directrices/reglement-sang/ligne-directrice-reglement-sang.html
Société internationale de transfusion sanguine : Groupe de travail sur l’hémovigilance : https://www.isbtweb.org/isbt-working-parties/haemovigilance.html (en anglais)
Guide de l’INSPQ (janvier 2023) : https://www.inspq.qc.ca/publications/3355
Réglement sur les instruments médicaux : https://laws-lois.justice.gc.ca/fra/reglements/DORS-98-282/
Déclaration obligatoire des réactions indésirables graves à un médicament et des incidents liés aux instruments médicaux par les hôpitaux - Document d’orientation : https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/medeffet-canada/declaration-effets-indesirables/declaration-obligatoire-hopitaux/medicaments-instruments/orientation.html
Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa) : https://laws-lois.justice.gc.ca/fra/LoisAnnuelles/2014_24/page-1.html
Système de surveillance des incidents transfusionnels, manuel de l’utilisateur, version 3 de l’Agence de la santé publique du Canada, 2007 (en anglais)
Gregg MB, éd. Field Epidemiology. 2e éd. New York, NY : Oxford University Press. 2002.
Yan, M. Déclaration des réactions transfusionnelles indésirables. Janvier 2020. Société canadienne du sang. https://professionaleducation.blood.ca/fr/transfusion/publications/sommaire-des-reactions-transfusionnelles-indesirables
Appendices
Déclaration de réactions transfusionnelles indésirables chez un receveur soumise par les hôpitaux au Programme Canada Vigilance de Santé Canada et au Système de surveillance des incidents transfusionnels (SSIT) de l’Agence de la santé publique du Canada
Le lien suivant mène à un portail interactif utile pour prendre des décisions en lien avec la déclaration des RTI.
https://redcap.link/CanadianWHOtoreportTransfusionReactionAlgorithm


